对活体高速高分辨率长时观测能力矢志不渝的追求,贯穿了显微技术几个世纪的发展史,是生命科学和医学研究的破冰船,是发现新现象、揭示新机制的先行官。然而受到三维组织分布、光学像差、光毒性等诸多胶着问题的限制,在哺乳动物活体环境下进行高速亚细胞分辨率长时程观测始终悬而未决,极大地制约了脑科学、肿瘤学与免疫学的深入研究。
2021年5月25日,CAAI理事长、清华大学脑与认知科学研究院、自动化系戴琼海院士课题组,生命科学学院俞立课题组合作在Cell上发表了题为 Iterative tomography with digital adaptive optics permits hour-long intravital observation of 3D subcellular dynamics at millisecond scale 的研究论文。该团队独辟蹊径地提出了数字自适应光学框架,发明了扫描光场成像技术,历经三年的攻关,研制了扫描光场显微镜,合称为 (Digital Adaptive Optics Scanning Lightfield Mutual Iterative Tomography, DAOSLIMIT)。DAOSLIMIT在225×225×16 μm3的成像视野范围内,以横向220nm和轴向400nm光学衍射极限分辨率,将以毫秒级活体三维连续观测时长从数分钟提高到小时级,活体成像时空分辨率提升两个数量级,光毒性降低三个数量级,为揭示哺乳动物活体多细胞、多细胞器间的相互作用提供了全新路径。

传统光场显微镜,虽能够在单次拍摄下记录样本多角度信息,实现快速三维成像,但空间分辨率与角度分辨率无法兼顾;DAOSLIMIT通过高速振镜的小范围振动,引入空间叠层约束,以全光子效率获取高分辨率的空间与角度四维全光场信息,实现了非相干的孔径合成,进而利用样本时空连续性先验,避免了扫描带来的时间分辨率损失。
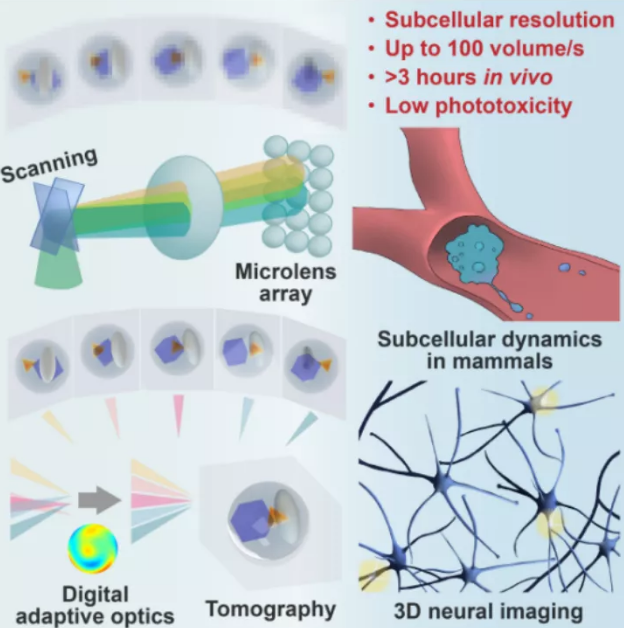
图1.DAOSLIMIT系统概念与原理应用示意
制约活体组织观测的一大瓶颈,是样本折射率三维空间分布各异引起的严重光学像差,显著降低了显微成像的空间分辨率。源于天文观测的传统自适应光学显微镜,即使通过复杂的软硬件也只能实现小视场区域的像差矫正成像。DAOSLIMIT建立了一套新的数字自适应光学 (DAO) 成像的框架,且无需额外的波前传感器或空间光调制器,通过获取四维全光信息将信号采集与自适应波前矫正解耦,在后处理的过程中实现大范围空间分块自适应光学矫正,将空间分辨率提升至光学衍射极限。
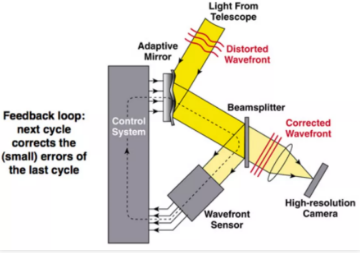
图2.自适应光学原理示意【1】
光照带来的光毒性问题,是活体荧光成像另一个长期痛点。转盘共聚焦显微镜(SDCM)、双光子显微镜 (Two-photon microscopy) 因存在非成像的激光照射区域,连续几分钟的高速拍摄就会给样本带来严重的光漂白/光损伤效应;光片显微镜(LSM)通过仅激发聚焦区域来缓解这一问题,但无法不透明组织中保持亚细胞分辨率。DAOSLIMIT采用了在同一个三维区域同时激发、同时采集的模式,通过轴向景深的拓展,充分利用了每一个光子进行成像。相对于常规显微镜而言,仅需μW量级的激发光强就可获得足够信噪比,使光毒性下降了整整三个数量级,国际上首次实现了哺乳动物活体内连续数小时的毫秒级高速持续观测。
图3. 在活体小鼠脾脏成像实验中,DAOSLIMIT与SDCM, Two-photon microscopy的光毒性对比
迁移体(migrasome)是俞立实验室最近发现并命名的新细胞器,现在已知迁移体在胚胎发育,免疫系统稳态维持中起重要作用。借助DAOSLIMIT,得以开创哺乳动物活体环境中迁移体功能研究的新领域。研究人员将中性粒细胞和血管分别进行染色,在活体小鼠肝脏内进行多色成像,首次清晰地观测到了迁移体和丝状伪足在哺乳动物体内的生成与变化。“通过DAOSLIMIT,我们观测到了免疫细胞在活体小鼠肝脏血管内运动过程中会留下许多迁移体。免疫细胞有可能通过产生迁移体实现大范围的信息交流,以及细胞间远距离的作用,这可能是一种新的机制。这些迁移体就像长城的烽火台一样,可能在一系列复杂反应比如免疫监控中起到了传递信号的关键作用。”俞立教授谈到。

图.活体小鼠肝脏体内免疫反应高速高分辨成像(GIF图)
研究人员进一步将人体肿瘤细胞注射入活体斑马鱼幼虫体内,借助DAOSLIMIT极弱的光毒性,在连续高速长时间观测中发现肿瘤细胞通过囊泡和丝状结构主动适应环境的新现象。戴琼海教授指出“新的仪器技术为生命科学和医学研究提供了新路径,这些有趣的新现象仅仅只是冰山一角。随着技术进步,未来更多新现象的发现、新机制的揭示,有望助力脑科学、肿瘤、免疫等关乎人民生命健康的重大基础研究产生新的突破”。
图5. 活体斑马鱼体内活体肿瘤转移高速高分辨成像
清华大学自动化系博士后吴嘉敏、博士研究生卢志、生命学院博士后姜东为该论文的共同第一作者,清华大学自动化系、北京信息科学与技术国家研究中心、脑与认知科学研究院戴琼海教授,范静涛副研究员,生命学院俞立教授为论文共同通讯作者。据悉,相关技术已经在落地转化。
原文链接:
https://doi.org/10.1016/j.cell.2021.04.029
制版人:十一
参考文献
[1] Max C. "Introduction to adaptive optics and its history." American Astronomical Society 197th Meeting. NSF Center for Adaptive Optics University of California at Santa Cruz and DOE Lawrence Livermore National Laboratory. (2001).
转自 BioArt
责编丨迦溆
原文链接:https://mp.weixin.qq.com/s/ab1Tq6hIiIFOHx7P-8GHBQ
- 党政机关科协
- 地方学会
- 兄弟学会
- 国际组织
- 常务理事单位
- 理事单位
- 会员服务
- 高校机构





